Aminosäuren sind chemisch gesehen Carbonsäuren mit einer Aminogruppe und müssten daher korrekt als Aminocarbonsäuren bezeichnet werden. Die einfachste Aminosäure ist das Glycin, das sich direkt von der Essigsäure ableitet und daher auch als Aminoessigsäure bezeichnet werden kann:
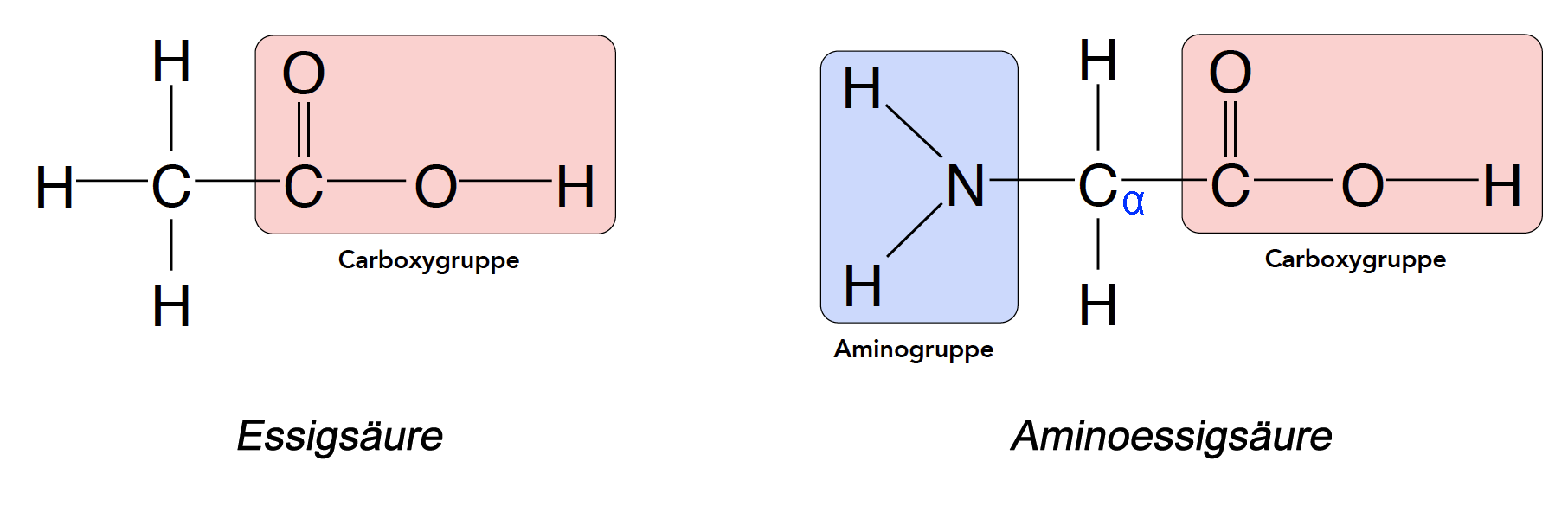
Aminosäuren sind mit der Essigsäure verwandt
Autor: Ulrich Helmich, Lizenz: siehe Seitenende
Die zweiteinfachste Aminosäure ist das Alanin (2-Amino-propansäure):
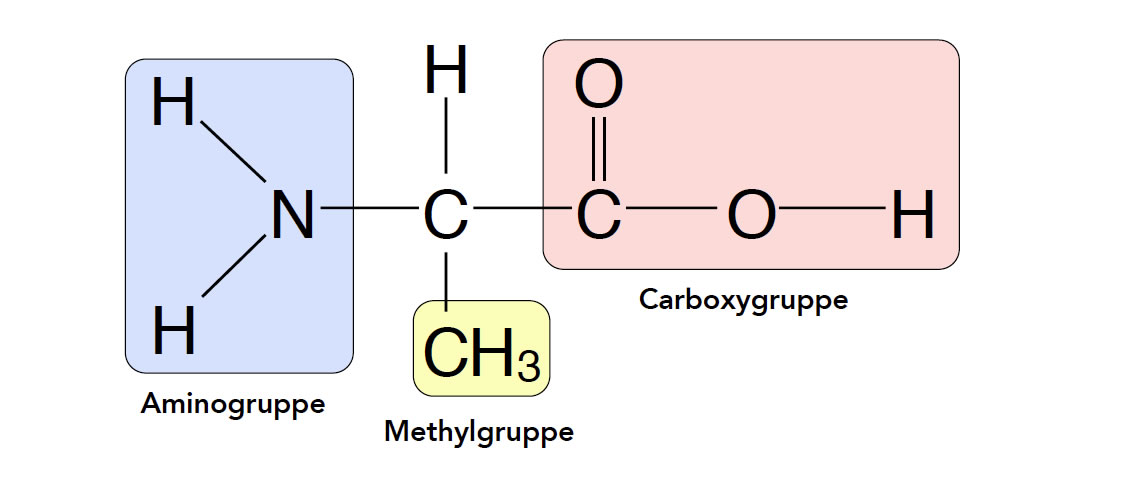
Das Alanin-Molekül
Autor: Ulrich Helmich, Lizenz: siehe Seitenende
Beim Alanin sind zwei H-Atome der Essigsäure durch andere Atomgruppen ersetzt worden. Das eine H-Atom wurde durch eine Aminogruppe ersetzt, das andere H-Atom durch eine Methylgruppe. Die Methylgruppe verlängert die Kettenlänge des Kohlenstoff-Grundgerüsts, so dass das Alanin kein Essigsäure-Derivat mehr ist, sondern ein Propansäure-Derivat, nämlich die 2-Amino-propansäure.
Allgemeiner Aufbau einer Aminosäure
Es gibt Hunderte von Aminosäuren in Natur und Technik, aber interessant sind eigentlich nur die sogenannten proteinogenen Aminosäuren (proteino-gen = Protein bildend). Diese 20 bzw. 21 Aminosäuren (Selenocystein gilt inzwischen auch als proteinogene Aminosäure) sind nämlich die Bausteine der Peptide und Proteine. Hier einmal der allgemeine Aufbau einer proteinogenen Aminosäure:
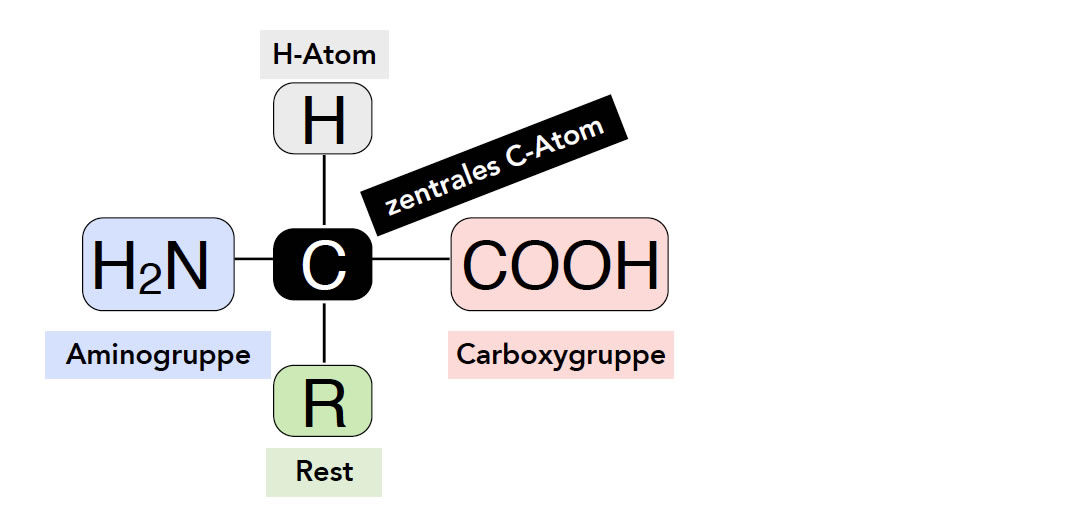
Allgemeiner Grundaufbau einer biogenen Aminosäure
Autor: Ulrich Helmich, Lizenz: siehe Seitenende
Ein zentrales C-Atom ist verbunden mit
- einer Aminogruppe NH2 (daher die Vorsilbe "Amino")
- einer Carboxygruppe COOH (daher die Nachsilbe "säure")
- einem H-Atom
- einem variablen Rest
Eigenschaften der Carboxy- und der Aminogruppe
Die Carboxygruppe ist sauer
Die Carboxygruppe verleiht der Aminosäure ihre sauren Eigenschaften. Sie ist in der Lage, ein Proton an eine Base (einen Protonen-Akzeptor) abzugeben. Dazu muss das Lösemittel natürlich eine solche Base, beispielsweise OH--Ionen, in hinreichender Konzentration besitzen. Das ist bei einem alkalischen Lösemittel der Fall, zum Beispiel bei verdünnter Natronlauge.
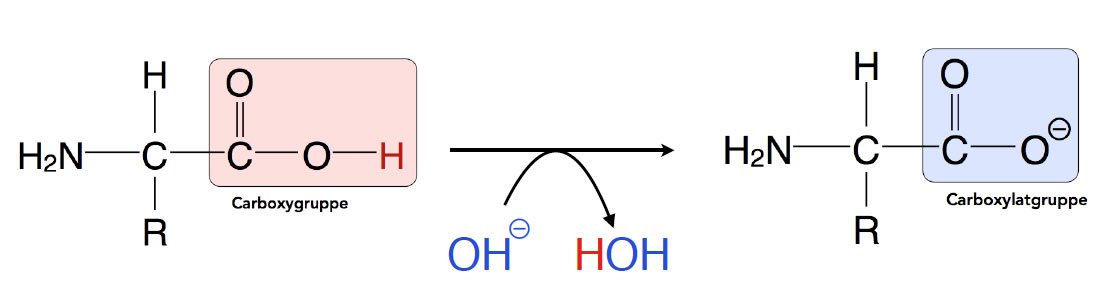
Die Carboxygruppe kann ein Proton an eine Base abgeben
Autor: Ulrich Helmich, Lizenz: siehe Seitenende
Wenn die Carboxygruppe dann ihr H-Atom in Form eines Protons an eine Base abgegeben hat, liegt sie als negativ geladene Carboxylatgruppe COO- vor.
Typischer Fehler vieler Schüler und auch Schülerinnen:
"Die Carboxygruppe gibt ein H-Atom ab"
Das ist nicht korrekt. Das H-Atom wird zwar abgegeben, aber nicht als neutrales H-Atom, sondern in Form eines positiv geladenen Protons H+.
Würde das H-Atom tatsächlich als neutrales H-Atom abgegeben, so würde entweder gasförmiger und explosiver Wasserstoff entstehen, was für die Zellen gar nicht gut wäre, oder das H-Atom müsste auf ein Coenzym wie FAD oder NADH+ übertragen werden, wie es zum Beispiel bei der Atmungskette in den Mitochondrien der Fall ist.
Die Aminogruppe ist basisch
Die Aminogruppe verleiht der Aminosäure ihre basischen Eigenschaften. Die Aminogruppe hat ein elektronegatives Stickstoff-Atom mit einem freien Elektronenpaar und verhält sich daher als Base, kann also ein Proton aufnehmen und dadurch zur NH3+-Gruppe werden:
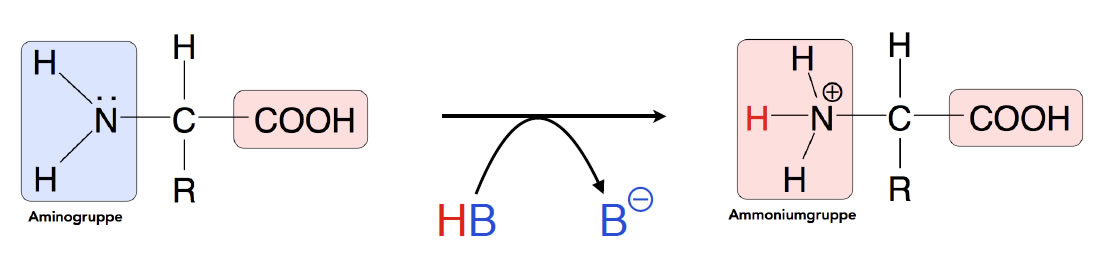
Die Aminogruppe kann ein Proton von einer Säure aufnehmen
Autor: Ulrich Helmich, Lizenz: siehe Seitenende
Das Proton H+ muss natürlich irgendwo herkommen, also funktioniert diese Protonenaufnahme nur dann, wenn ein Protonen-Donator, also eine Säure, im Lösemittel vorkommt. In der Abbildung wird die Säure durch HB symbolisiert.
Das ist die typische Schreibweise der Chemie. Das H steht für das H-Atom, das in Form eines Protons abgegeben werden kann. Das B steht für den Säurerest, der das Proton wieder aufnehmen kann und damit formal eine Base ist. Daher wird der Säurerest hier als B- bezeichnet.
Bildung von Zwitterionen
Aminosäuren können bei bestimmten pH-Werten sogenannte Zwitterionen bilden:
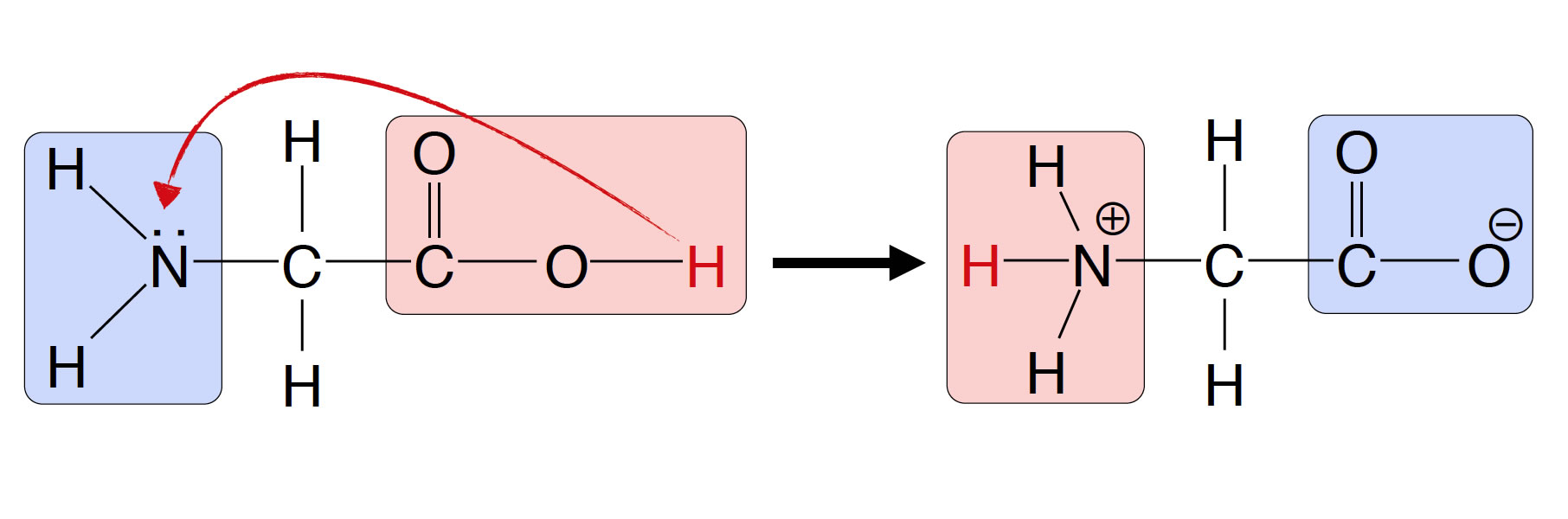
Bildung eines Zwitterions
Autor: Ulrich Helmich, Lizenz: siehe Seitenende
Die Carboxygruppe reagiert als Säure und gibt ein Proton ab, die Aminogruppe reagiert als Base und nimmt ein Proton auf. Es entsteht ein Zwitterion, das gleichzeitig negativ und positiv geladen ist.
Ob das abgegebene Proton sich dann an die Aminogruppe der selben Aminosäure setzt, wie es in der Abbildung angedeutet ist und auch in vielen Büchern steht, ist aber eher unwahrscheinlich. Wahrscheinlicher ist, dass das Proton an das Lösemittel abgegeben wird und dass sich gleichzeitig ein anderes Proton aus dem Lösemittel an die Aminogruppe anlagert.
Die pH-Abhängigkeit der Ladung einer Aminosäure
Eine Aminosäure kann je nach pH-Wert des Lösemittels positiv oder negativ geladen sein oder als Zwitterion vorliegen. Betrachten wir dazu die folgende Abbildung:
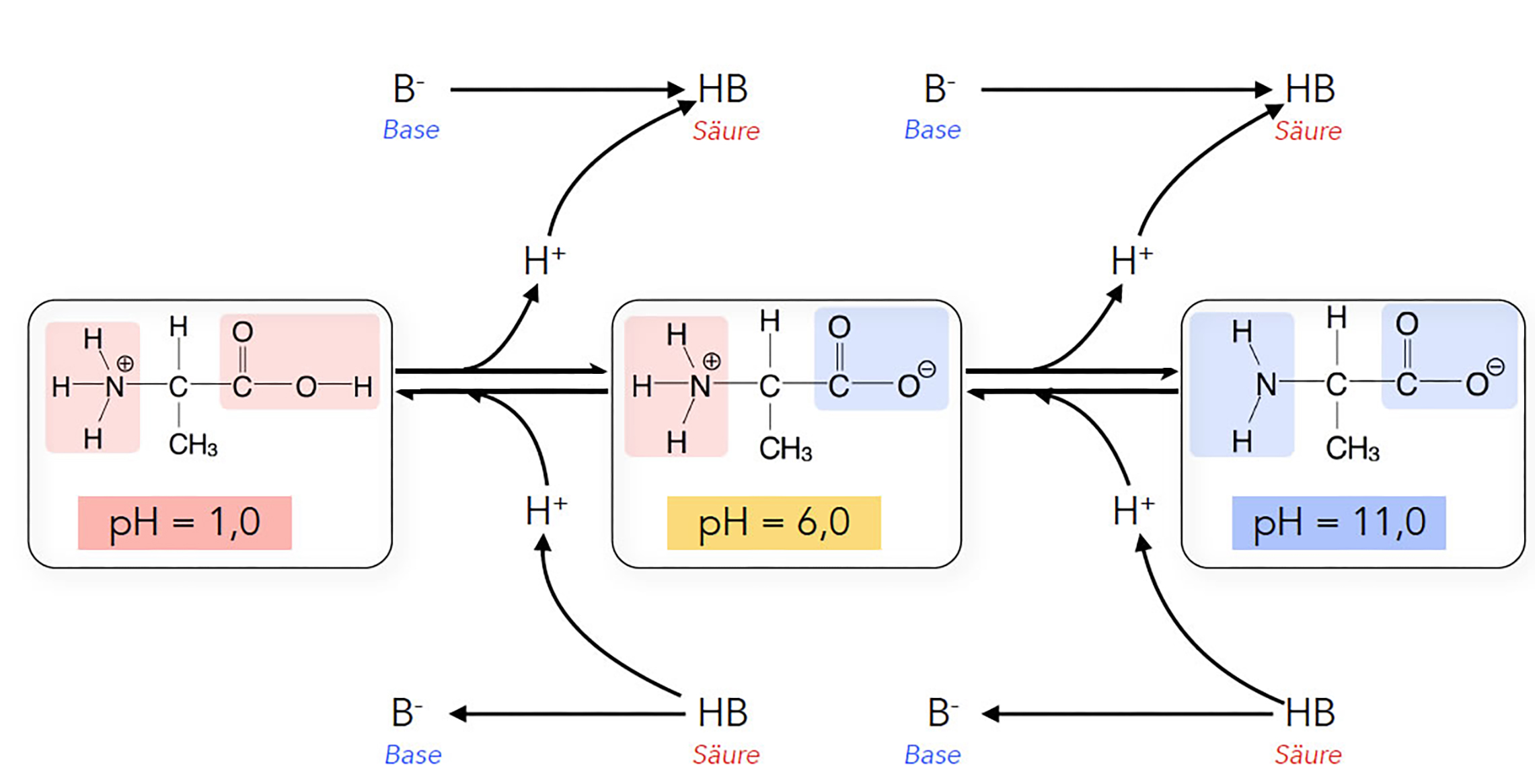
Die pH-Abhängigkeit der Ladung einer Aminosäure
Autor: Ulrich Helmich, Lizenz: siehe Seitenende
Bei einem pH-Wert von 1 (stark sauer, hohe H+-Konzentration im Lösemittel) hat die basische Aminogruppe ein Proton aufgenommen, und die COOH-Gruppe gibt ihr Proton in einem stark protonenreichen Lösemittel natürlich nicht ab. Die Aminosäure liegt also positiv geladen vor.
Gibt man jetzt eine Lauge in das Lösemittel, steigt der pH-Wert, die Konzentration der OH--Ionen im Lösemittel nimmt zu, und die Konzentration der H+-Ionen nimmt ab. Warum das so ist, wird im nächsten Kasten erklärt.
Für Chemie-Experten:
Das Produkt der beiden Konzentrationen c(H+) * c(OH-) ist in einem wässrigen Lösemittel bei Zimmertemperatur immer konstant, nämlich 10-14 mol2/l2. Das heißt, wenn man c(H+) kennt (zum Beispiel durch Messung des pH-Wertes), dann kann man c(OH-) leicht ausrechnen. Ist c(H+) beispielsweise 10-5 mol/l (pH=5), dann muss c(OH-) den Wert 10-9 mol/l haben, denn 10-5 * 10-9 ergibt wieder 10-14.
Erhöht man jetzt c(OH-) durch Zugabe einer Lauge, dann sinkt automatisch c(H+), so dass das Produkt beider Konzentrationen immer konstant bleibt.
Noch eine Experten-Frage:
Wieso gibt eigentlich die Carboxygruppe ihr Proton ab, wenn der pH-Wert steigt, und nicht die positiv geladene NH3+-Gruppe?
Eine Chemikerin würde das so erklären: Es gibt starke und schwache Säuren. Starke Säuren geben ihr Proton sehr leicht und schnell ab, schwache Säuren geben ihr Proton nicht so schnell ab.
Chlorwasserstoff HCl ist zum Beispiel eine sehr starke Säure. Löst man HCl in Wasser, so liegen alle HCl-Moleküle in dissoziierter Form vor, haben also ihr H-Atom als Proton an Wasser-Moleküle abgegeben (die dann zu Oxonium-Ionen H3O+ werden).
Essigsäure CH3COOH dagegen ist eine schwache Säure. Löst man Essigsäure in Wasser, so gibt nur ca. jedes hundertste Molekül ein Proton an ein Wasser-Molekül ab.
Offensichtlich hat die Carboxygruppe stärkere Säureeigenschaften als die NH3+-Gruppe, denn sie gibt ihr Proton zuerst ab und liegt dann als negativ geladene COO--Gruppe vor, während die Aminogruppe immer noch als NH3+-Gruppe vorliegt. Die Aminosäure existiert jetzt also als Zwitterion.
Sobald der pH-Wert durch Zugabe einer Säure wieder etwas sinkt, nimmt die COO--Gruppe des Zwitterions erneut ein Proton auf, und wenn der pH-Wert durch Zugabe einer Lauge etwas steigt, gibt die NH3+-Gruppe ihr Proton ab. Als Zwitterion liegt die Aminosäure also nur bei einem ganz bestimmten pH-Wert vor. Diesen pH-Wert bezeichnet man als isoelektrischen Punkt.
Isoelektrischer Punkt = der pH-Wert, bei dem eine Aminosäure als Zwitterion vorliegt.
Bei einem pH-Wert von 11 liegt unsere Aminosäure (hier Alanin) als negativ geladenes Ion vor, die Carboxygruppe hat ihr Proton abgegeben und ist daher negativ geladen, und die Aminogruppe liegt als neutrale NH2-Gruppe vor.
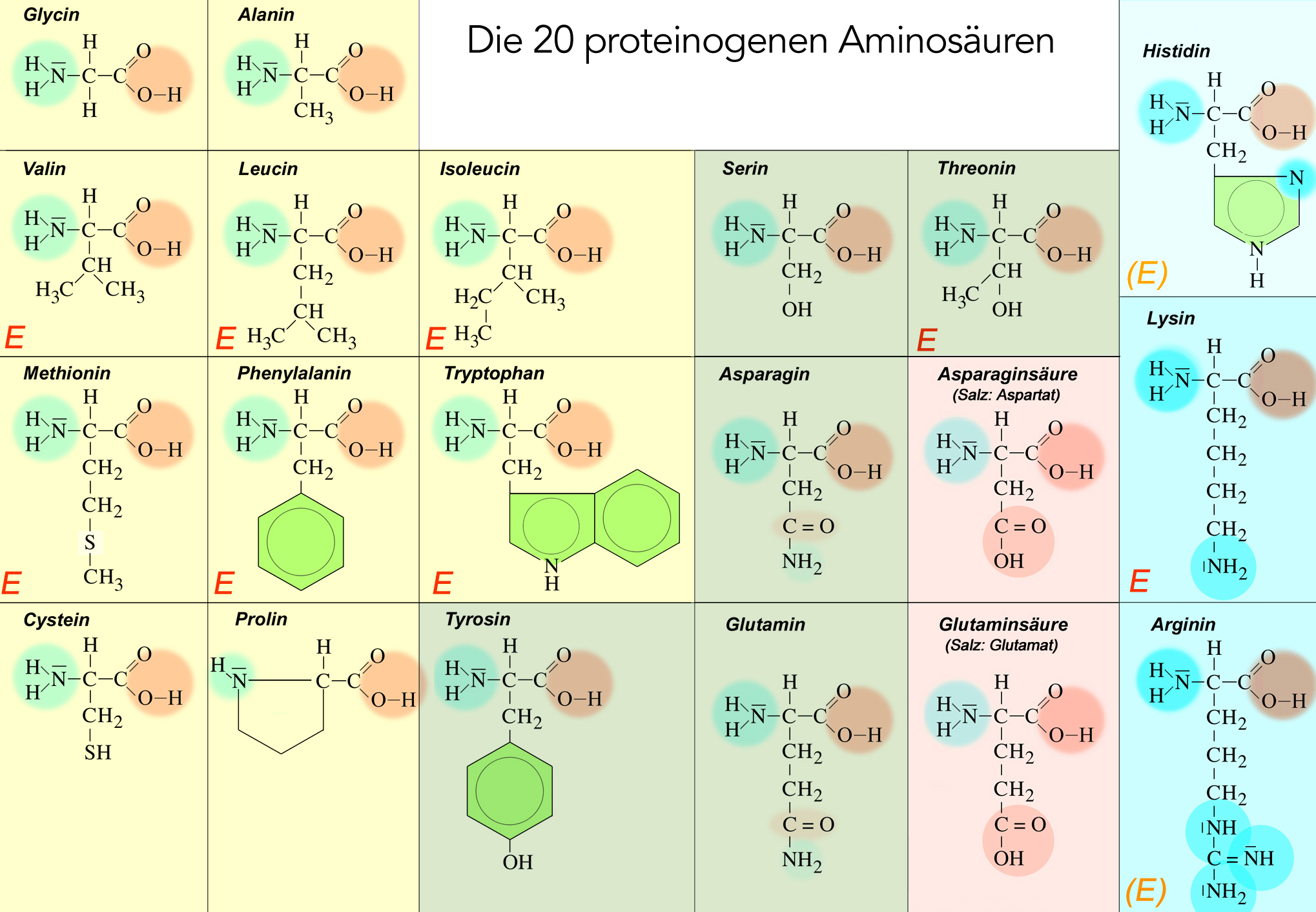
Überblick über die 20 biogenen Aminosäuren
Hier sehen Sie alle 20 proteinogenen Aminosäuren; ich hoffe, ich habe sie alle korrekt gezeichnet. Die 21. Aminosäure, das Selenocystein, sieht aus wie ein Cystein-Molekül, allerdings ist das Schwefel-Atom durch ein Selen-Atom ersetzt.
Einteilung der Aminosäuren
Die 21 proteinogenen Aminosäuren kann man nach verschiedenen Kriterien in mehrere Gruppen einteilen. In der Ernährungslehre und Medizin sehr beliebt ist die Einteilung in essentielle und nicht-essentielle Aminosäuren. In der Fachliteratur findet man aber auch andere Einteilungen der Aminosäuren, zum Beispiel in Aminosäuren mit unpolaren und polaren Seitenketten, in neutrale, saure und basische Aminosäuren, in aromatische und nicht-aromatische Aminosäuren und so weiter.
Essentielle Aminosäuren
Viele einfache Aminosäuren können vom menschlichen Körper selbst hergestellt werden. Einige Aminosäuren müssen aber zwingend mit der Nahrung aufgenommen werden. Diese Aminosäuren bezeichnet man als essentielle Aminosäuren.
Essentielle Aminosäuren = Aminosäuren, die der Körper nicht selbst herstellen kann und die darum mit der Nahrung aufgenommen werden müssen.
Die essentiellen Aminosäuren sind in der Abbildung durch ein rotes E gekennzeichnet. Es handelt sich um die Aminosäuren Valin, Leucin, Isoleucin, Cystein, Phenylalanin, Tryptophan, Threonin und Lysin. Die Aminosäuren Histidin und Arginin sind für Erwachsene nicht mehr essentiell, wohl aber für jüngere Kinder.
Aminosäuren mit unpolaren bzw. polaren Seitenketten
Aminosäuren mit unpolaren Seitenketten
Die Aminosäuren mit unpolaren Resten sind in dem Bild oben leicht grau unterlegt. Es handelt sich um die Aminosäuren Glycin, Alanin, Valin, Leucin, Isoleucin, Methionin, Phenylalanin, Tryptophan und Prolin.
Aminosäuren mit polaren neutralen Seitenketten
Diese Aminosäuren haben zwar polare Reste, die aber weder sauer noch basisch reagieren. Dazu gehören die im Bild grün hinterlegten Aminosäuren Cystein, Tyrosin, Serin, Threonin, Asparagin und Glutamin. Die Polarität der Seitenketten wird durch die NH2- und OH- bzw. SH-Gruppen verursacht.
Aminosäuren mit polaren sauren Seitenketten ( = "saure Aminosäuren")
Asparaginsäure und Glutaminsäure (im Bild rot unterlegt) haben in der Seitenkette eine Carboxygruppe, deren Säureaktivität durch kein N-Atom eingeschränkt wird. Diese beiden Aminosäuren können das Proton der Seitenketten-COOH-Gruppe leicht abgeben, dann entstehen die Salze Aspartat bzw. Glutamat.
Aminosäuren mit polaren basischen Seitenketten ( = "basische Aminosäuren")
Hierzu gehören die im Bild blau unterlegten Aminosäuren Histidin, Lysin und Arginin. Die NH2-Gruppe in der Seitenkette ist basisch und kann ein Proton aufnehmen. Auch Glutamin hat eine NH2-Gruppe in der Seitenkette, deren Basizität wird jedoch durch die direkt benachbarte Carbonylgruppe stark reduziert, so dass Glutamin zu den polaren neutralen Aminosäuren gezählt wird.
Weitere interessante / ungewöhnliche Aminosäuren
Interessant sind noch die vier Aminosäuren mit einem aromatischen Ring in der Seitenkette. Die aromatischen Ringe sind in der Abbildung durch eine grüne Füllung gekennzeichnet. Es handelt sich um die Aminosäuren Phenylalanin, Tryptophan, Tyrosin und Histidin.
Interessant sind auch die beiden schwefelhaltigen Aminosäuren Methionin und vor allem Cystein. Cystein ist vor allem wegen seiner Fähigkeit wichtig, Disulfidbrücken mit einem zweiten Cystein-Molekül bilden zu können. Eng verwandt mit dem Cystein ist das Selenocystein, bei dem das S-Atom durch ein Se-Atom ersetzt ist.
Völlig ungewöhnlich ist schließlich die Aminosäure Prolin. Prolin besitzt keine Aminogruppe, sondern das N-Atom ist über eine Brücke aus drei CH2-Gruppen mit dem zentralen C-Atom verbunden. Das Prolin-Molekül beißt sich sozusagen in den eigenen Schwanz.